- シムジア®の特徴
- シムジア®の物質特性
- 薬物動態
- 作用機序
-
- シムジア®のデバイス
シムジア®について
臨床成績
国内第Ⅱ/Ⅲ相試験(PS0017試験)
〈尋常性乾癬患者(乾癬性関節炎の合併例を含む)〉
PASI反応率〔主要評価項目(検証項目)/副次評価項目:16週時のPASI75/90反応率〕
16週時のPASI75反応率(FAS-MCMC)a)は、シムジア®400mgQ2W群で87.1%、シムジア®200mgQ2W群で73.0%、プラセボ群で7.9%であり、いずれもプラセボ群に比べ有意に高いことが検証されました(いずれもp<0.0001:ロジスティック回帰分析)。
PASI90反応率(FAS-NRI)b)
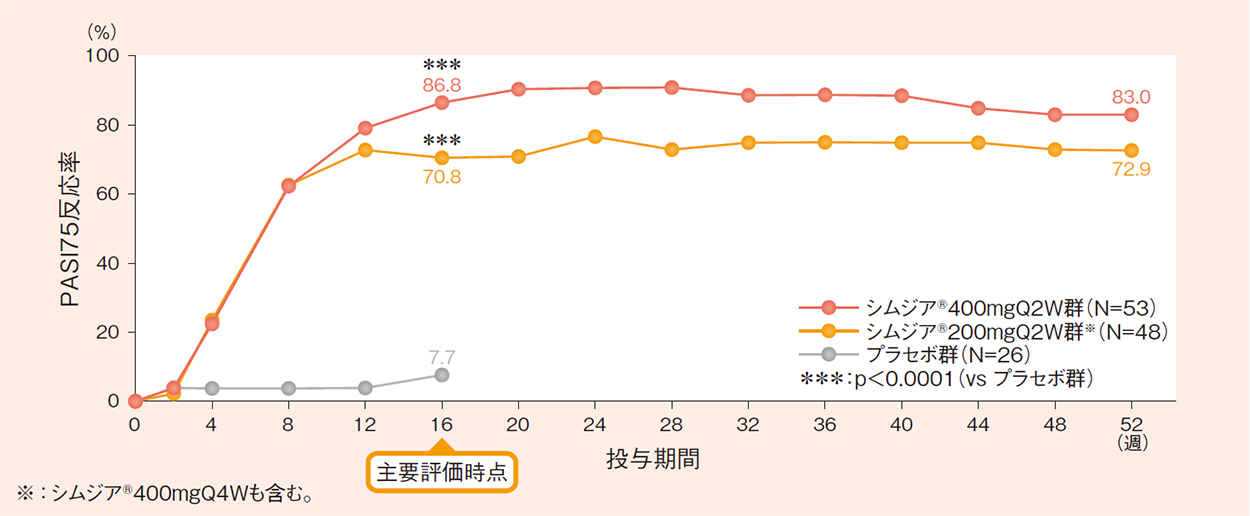
- a)
- MCMC法を用いて欠測値を補完した。
- b)
- NRI法を用いて欠測値を補完した。
- 16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率は、MCMC法による解析を主解析、NRI法による解析を補足的解析として評価した。 また、0~52週の有効性評価項目(主要及び副次評価項目)は、試験全体の推移を把握するため、NRI法による補足的解析結果を記述した。
- p値は投与群及び過去の生物学的製剤の使用の有無を因子としたロジスティック回帰分析(有意水準:両側2.5%)を用いて算出した。
- PASI:乾癬面積・重症度指標、FAS:最大の解析対象集団、MCMC法:マルコフ連鎖モンテカルロ法、NRI:Non-responder imputation
BMIで3区分した16週時のPASI90反応率(FAS-NRI)〔部分集団解析〕
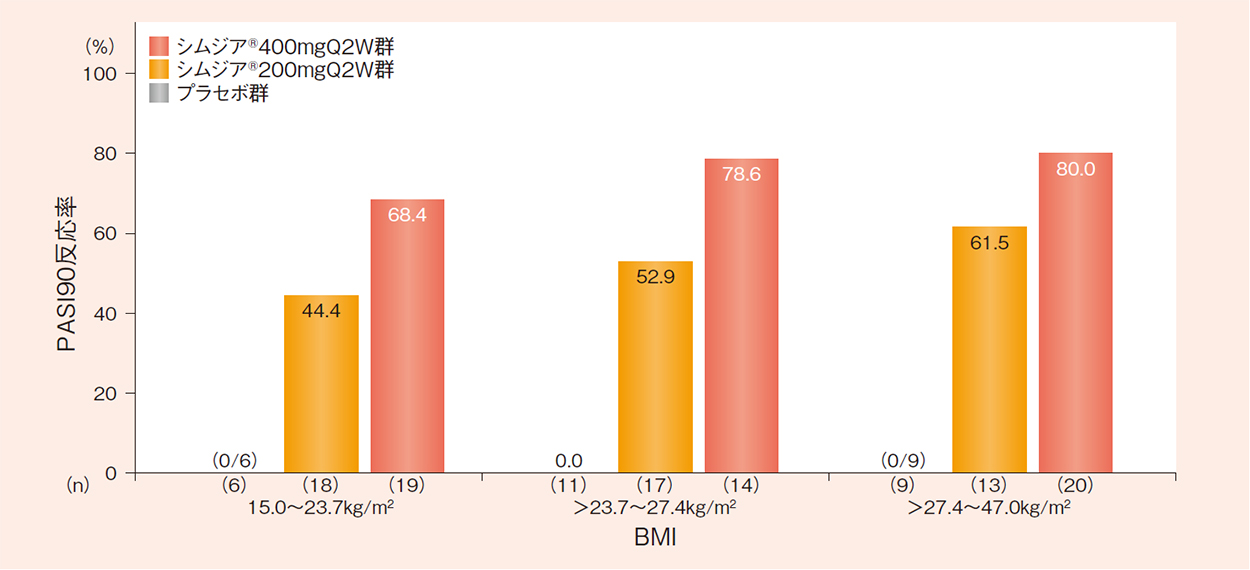
NRI法を用いて欠測値を補完した。
BMI:体格指数、PASI:乾癬面積・重症度指標、FAS:最大の解析対象集団、NRI:Non-responder imputation
乾癬性関節炎患者の皮膚症状及び関節症状に対する効果
ベースライン時の圧痛関節数及び腫脹関節数がいずれも3以上(OJS3+)認められた乾癬性関節炎患者におけるPASI/DAS28-CRP/ACR反応は以下のとおりでした。
PASI/DAS28-CRP/ACR反応(PsA-OJS3+)〔部分集団解析〕
| 投与群 | 皮膚症状 | |||||||
|---|---|---|---|---|---|---|---|---|
| PASI | PASI反応(16週) | |||||||
| 投与前 | 16週 | 変化量 | 変化率(%) | PASI50 | PASI75 | PASI90 | PASI100 | |
|
シムジア® 200mg Q2W群 |
18.9 | 4.8 | -14.1 | -74.60 | Yes | No | No | No |
| 28.8 | 15.6 | -13.2 | -45.83 | No | No | No | No | |
| 14.7 | 13.0 | -1.7 | -11.56 | No | No | No | No | |
|
シムジア® 400mg Q2W群 |
27.9 | 0.9 | -27.0 | -96.77 | Yes | Yes | Yes | No |
| 15.0 | 1.8 | -13.2 | -88.00 | Yes | Yes | No | No | |
| 21.3 | 0 | -21.3 | -100.00 | Yes | Yes | Yes | Yes | |
| 15.3 | 6.6 | -8.7 | -56.86 | Yes | No | No | No | |
| 12.4 | 1.2 | -11.2 | -90.32 | Yes | Yes | Yes | No | |
| 投与群 | 関節症状 | ||||||
|---|---|---|---|---|---|---|---|
| DAS28-CRP | ACR反応(16週) | ||||||
| 投与前 | 16週 | 変化量 | 変化率(%) | ACR20 | ACR50 | ACR70 | |
|
シムジア® 200mg Q2W群 |
5.707 | 4.853 | -0.854 | -14.96 | No | No | No |
| 2.569 | 2.555 | -0.014 | -0.54 | No | No | No | |
| 5.354 | 6.398 | 1.044 | 19.49 | No | No | No | |
|
シムジア® 400mg Q2W群 |
2.923 | 1.751 | -1.172 | -40.09 | Yes | Yes | Yes |
| 2.898 | 2.120 | -0.779 | -26.87 | No | No | No | |
| 5.214 | 1.072 | -4.142 | -79.44 | Yes | Yes | Yes | |
| 6.277 | 1.280 | -4.998 | -79.62 | Yes | Yes | Yes | |
| 4.554 | 1.800 | -2.754 | -60.47 | Yes | Yes | No | |
PASI:乾癬面積・重症度指標、DAS28:28関節疾患活動性スコア、CRP:C反応性蛋白、ACR:米国リウマチ学会、OJS3+:ベースライン時の圧痛関節数及び腫脹関節数がいずれも3以上の患者
安全性
52週までの期間に発現した副作用は、シムジア®投与群全体で122例中39例(32.0%)に認められました。主な副作用はシムジア®投与群全体で鼻咽頭炎5例(4.1%)、乾癬4例(3.3%)等でした。
重篤な副作用は、シムジア®投与群全体で5例に認められ、潜伏結核2例、好中球減少症、血小板減少症、サルコイドーシス、帯状疱疹各1例でした(潜伏結核1例及び帯状疱疹は同一症例で発現)。
投与中止に至った有害事象は、シムジア®投与群全体で9例に認められ、乾癬4例、血小板減少症、肝障害、アルコール性肝疾患、AST増加、間質性肺疾患各1例でした。
本試験において死亡に至った有害事象は認められませんでした。
なお、0〜16週では、プラセボ群26例中6例(23.1%)に副作用が認められ、乾癬3例(11.5%)等でした。投与中止に至った有害事象は乾癬2例でした。16週までに重篤な副作用及び死亡に至った有害事象は、プラセボ群で認められませんでした。
16~52週では、プラセボ群4例中1例(25.0%)に副作用が認められました。重篤な副作用、投与中止に至った有害事象及び死亡に至った有害事象は認められませんでした。
試験概要
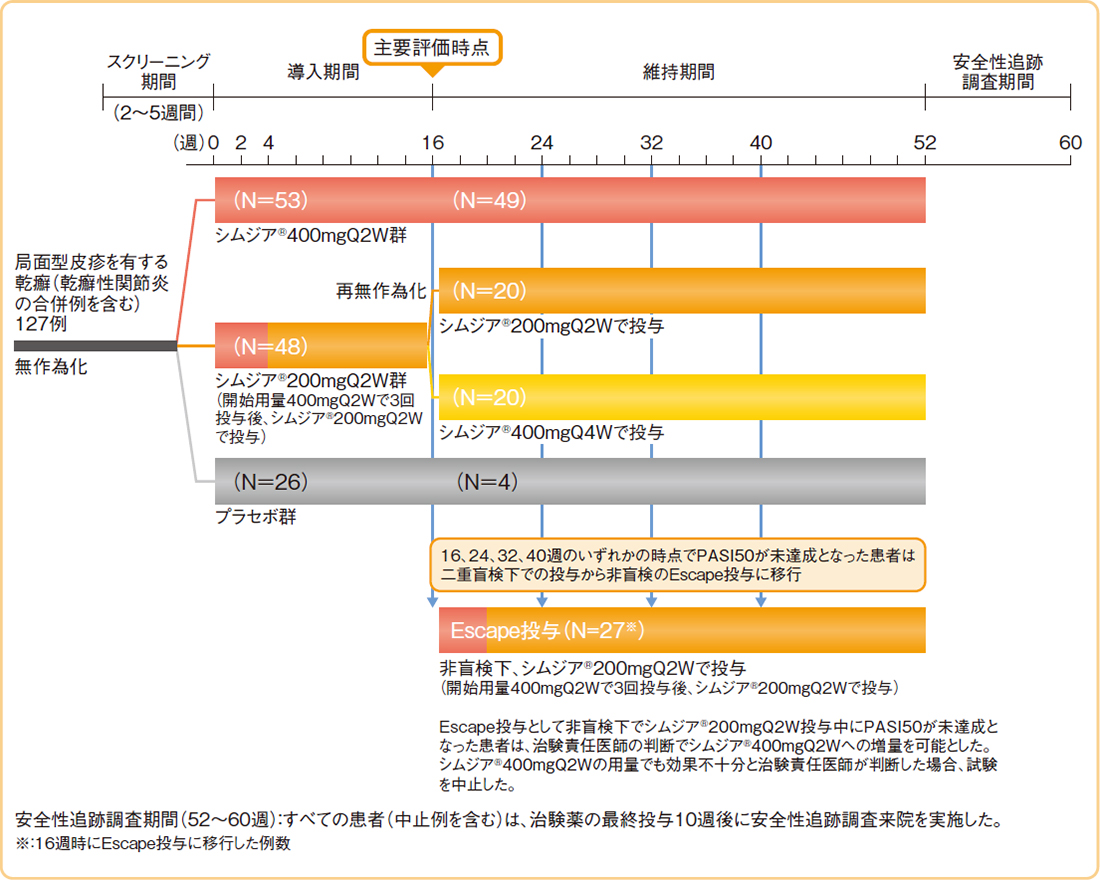
Q2W:2週間隔、Q4W:4週間隔
- 【対象】
-
中等度~重度の尋常性乾癬患者(乾癬性関節炎の合併例を含む) 127 例
- 局面型皮疹を有する乾癬(尋常性乾癬及び乾癬性関節炎)の診断を受けて6ヵ月以上経過している患者
- ベースラインのPASIスコア≧12、病変BSA≧10%、及びPGAスコア≧3の患者
- 乾癬の全身療法及び/又は光線療法及び/又は光化学療法の対象となる患者
[ただし、乾癬性紅皮症又は膿疱性乾癬の患者、過去にシムジア®を投与された患者、乾癬又は乾癬性関節炎の治療のために3種類以上の生物学的製剤(TNF阻害薬を含む)を使用した患者を除く]
- 【デザイン】
- 多施設共同、二重盲検、無作為化、プラセボ対照、並行群間比較
- 【投与方法】
- シムジア®400mgQ2W群、シムジア®200mgQ2W群又はプラセボ群のいずれかに2:2:1の割合で無作為に割り付け、2週間隔で14週時まで皮下投与した(シムジア®200mgQ2W群はシムジア®400mgQ2Wで3回投与後、シムジア®200mgQ2Wで投与)。16週時にPASI50を達成したシムジア®400mgQ2W群及びプラセボ群の患者は投与を継続、シムジア®200mgQ2W群の患者はシムジア®200mgQ2W投与又はシムジア®400mgQ4W投与に1:1の割合で再割付けし、皮下投与した。また、16、24、32、40週時のいずれかの時点でPASI50が未達成となった患者は、Escape投与に移行し、非盲検下、シムジア®400mgQ2Wで3回投与後、シムジア®200mgQ2Wで皮下投与した。
- 【評価項目】
-
主要評価項目:16週時のPASI75反応率(検証項目)
副次評価項目:16週時のPASI90反応率 等
その他の評価項目:乾癬性関節炎の部分集団におけるPASI、DAS28-CRPのベースラインからの変化、ACR20/50/70反応率 等
- 【解析計画】
-
主要評価項目及び主な副次評価項目の統計解析は多重性を考慮し、固定順検定法を用いた。閉検定手順は、主要評価項目におけるシムジア®200mgQ2W群とプラセボ群の比較、シムジア®400mgQ2W群とプラセボ群の比較をそれぞれ有意水準両側2.5%で実施し、統計学的な有意差が認められた場合には、投与群毎に副次評価項目の仮説検定を有意水準両側2.5%の下、実施することとされた。各投与群において事前に規定した副次評価項目の全てで統計学的有意差が認められた場合には、有意水準両側2.5%をもう一方の投与群の解析に受け渡す計画とされた。
16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率におけるシムジア®の各投与群とプラセボ群との比較は、投与群及び過去の生物学的製剤の使用の有無を因子としたロジスティック回帰分析を用いて解析し、オッズ比、信頼区間及びp値で示した。16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率に対して部分集団解析(BMI別等)を実施し、記述統計量のみを算出した。部分集団の1つ以上のカテゴリーの患者数が全患者の10%未満だった場合は、その部分集団の解析を実施しなかった。また、PASI90維持率に対して部分集団解析を実施した。なお、部分集団解析は事前に規定されていた。
乾癬性関節炎に関する評価は、ベースライン時の圧痛関節数及び腫脹関節数がいずれも3以上の患者(OJS3+)を対象とした。
16週時のPASI75及びPASI90反応率、ならびにPGA 0/1達成率は、MCMC法による解析を主解析、NRI法による解析を補足的解析として評価した。また、0~52週の有効性評価項目(主要及び副次評価項目)は、試験全体の推移を把握するため、NRI法による補足的解析結果を記述した。
承認時評価資料 : 国内第Ⅱ/Ⅲ相二重盲検比較試験成績 PS0017試験
- 6.
-
用法及び用量(抜粋)
〈尋常性乾癬、関節症性乾癬、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを2週間の間隔で皮下注射する。症状安定後には、1回200mgを2週間の間隔、又は1回400mgを4週間の間隔で皮下注射できる。


