- シムジア®の特徴
- シムジア®の物質特性
- 薬物動態
- 作用機序
-
- シムジア®のデバイス
シムジア®について
臨床成績
国内第Ⅱ/Ⅲ相試験(PS0017試験)
〈乾癬性紅皮症及び膿疱性乾癬患者〉
臨床全般印象改善度(CGI-I)の経時的推移
両疾患におけるCGI-Iの改善は以下のとおりでした。
CGI-Iの経時的推移(CFAS-NRI)
| 寛解+改善 | 乾癬性紅皮症 | 膿疱性乾癬 | ||
|---|---|---|---|---|
| シムジア®200mgQ2W群(N=7) | シムジア®400mgQ2W群(N=8) | シムジア®200mgQ2W群(N=4) | シムジア®400mgQ2W群(N=3) | |
| 2週 | 4/7 | 5/8 | 3/4 | 3/3 |
| 4週 | 6/7 | 7/8 | 4/4 | 3/3 |
| 8週 | 5/7 | 7/8 | 4/4 | 3/3 |
| 12週 | 6/7 | 7/8 | 4/4 | 3/3 |
| 16週 | 6/7 | 8/8 | 4/4 | 3/3 |
| 寛解+改善 | 乾癬性紅皮症 | ||
|---|---|---|---|
| シムジア®200mgQ2W/ シムジア®200mgQ2W群 (N=4) |
シムジア®400mgQ2W/ シムジア®400mgQ2W群 (N=8) |
シムジア®200mgQ2W/ シムジア®400mgQ2W群 (N=2) |
|
| 16週 | 4/4 | 8/8 | 2/2 |
| 20週 | 3/4 | 7/8 | 2/2 |
| 24週 | 4/4 | 8/8 | 2/2 |
| 28週 | 4/4 | 7/8 | 2/2 |
| 32週 | 3/4 | 7/8 | 2/2 |
| 36週 | 3/4 | 6/8 | 2/2 |
| 40週 | 3/4 | 7/8 | 2/2 |
| 44週 | 3/4 | 7/8 | 2/2 |
| 48週 | 3/4 | 7/8 | 2/2 |
| 52週 | 3/4 | 7/8 | 2/2 |
| 寛解+改善 | 膿疱性乾癬 | ||
|---|---|---|---|
| シムジア®200mgQ2W/ シムジア®200mgQ2W群 (N=3) |
シムジア®400mgQ2W/ シムジア®400mgQ2W群 (N=3) |
シムジア®200mgQ2W/ シムジア®400mgQ2W群 (N=1) |
|
| 16週 | 3/3 | 3/3 | 1/1 |
| 20週 | 3/3 | 3/3 | 1/1 |
| 24週 | 3/3 | 3/3 | 1/1 |
| 28週 | 3/3 | 3/3 | 1/1 |
| 32週 | 3/3 | 3/3 | 1/1 |
| 36週 | 3/3 | 3/3 | 1/1 |
| 40週 | 3/3 | 3/3 | 1/1 |
| 44週 | 3/3 | 3/3 | 1/1 |
| 48週 | 3/3 | 3/3 | 1/1 |
| 52週 | 3/3 | 2/3 | 1/1 |
NRI法を用いて欠測値を補完した。
CGI-I:臨床全般印象改善度、CFAS:非盲検コホート最大解析対象集団、NRI:Non-responder imputation
安全性
52週までの期間に発現した副作用は、乾癬性紅皮症及び膿疱性乾癬において、15例中6例(40.0%)及び7例中3例(42.9%)に認められ、乾癬性紅皮症で乾癬2例(13.3%)、注射部位反応、単純ヘルペス、帯状疱疹、せつ、潜伏結核、咽頭炎、ALT増加、多形紅斑、光線過敏性反応各1例(6.7%)、膿疱性乾癬で好中球減少症、体部白癬、ざ瘡各1例(14.3%)でした。
重篤な副作用は、乾癬性紅皮症で多形紅斑1例、膿疱性乾癬で好中球減少症1例でした。
投与中止に至った有害事象は、乾癬性紅皮症で3例に認められ、潜伏結核、多形紅斑、乾癬各1例でした。膿疱性乾癬では、本試験において投与中止に至った有害事象は認められませんでした。
乾癬性紅皮症及び膿疱性乾癬のいずれにおいても、本試験において死亡に至った有害事象は認められませんでした。
試験概要
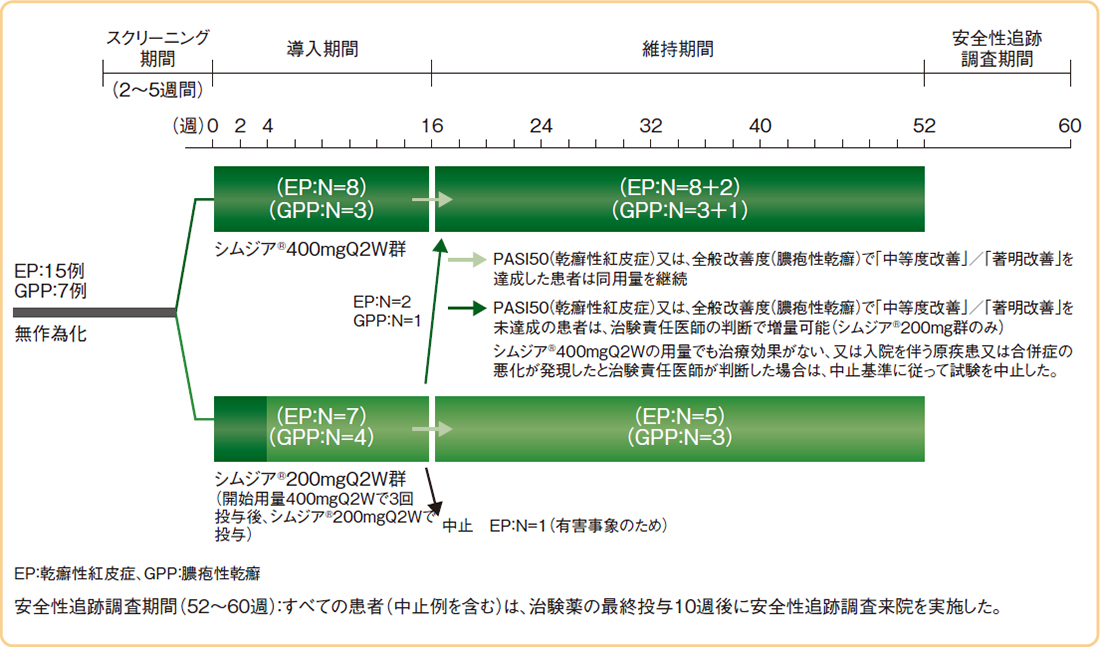
Q2W:2週間隔
- 【対象】
-
乾癬性紅皮症及び膿疱性乾癬患者 22例
- 乾癬性紅皮症:尋常性乾癬等の局面型皮疹を伴う乾癬の病歴があり、病変BSA≧80%の患者
- 膿疱性乾癬:日本皮膚科学会(JDA)の診断基準を満たす患者
[ただし、膿疱性乾癬患者でベースライン時にJDA重症度分類スコアの合計点数が14以上の患者、乾癬性紅皮症以外による紅皮症(リンパ腫や薬剤性発疹による紅皮症等)の患者、及び過去に生物学的製剤を使用して一次無効(治療開始から12週間の間に効果が得られなかった場合)であった治療歴を有する患者を除く]
- 【デザイン】
- 多施設共同、非盲検、無作為化
- 【方法】
- シムジア®200mgQ2W群又はシムジア®400mgQ2W群のいずれかに1:1の割合で無作為に割り付け、2週ごとに1回、14週間皮下投与した。16週時に全般改善度で「中等度改善」以上(膿疱性乾癬)/PASI50(乾癬性紅皮症)を達成した患者は同用量を継続し、未達成の患者は、医師の判断で継続、増量(200mg群の患者)又は中止した。
- 【評価項目】
- 臨床全般印象改善度(CGI-I)、PASI75/90反応率(乾癬性紅皮症)、全般改善度(膿疱性乾癬) 等
承認時評価資料 : 国内第Ⅱ/Ⅲ相二重盲検比較試験成績 PS0017試験
- 6.
- 用法及び用量(抜粋)
〈尋常性乾癬、関節症性乾癬、膿疱性乾癬、乾癬性紅皮症〉
通常、成人にはセルトリズマブ ペゴル(遺伝子組換え)として、1回400mgを2週間の間隔で皮下注射する。症状安定後には、1回200mgを2週間の間隔、又は1回400mgを4週間の間隔で皮下注射できる。


